Anhydride acétique
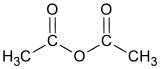
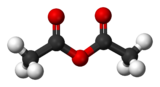
L'anhydride acétique ou anhydride éthanoïque est l'anhydride de l'acide acétique ; il est obtenu en liant deux molécules d'acide acétique par condensation avec élimination d'eau.
| Anhydride acétique | |||
|---|---|---|---|
  |
|||
| formule semi-développée et représentation 3D de l'anhydride acétique | |||
| Général | |||
| Nom IUPAC | Anhydride éthanoïque | ||
| No CAS | |||
| No EINECS | |||
| SMILES |
|
||
| InChI |
|
||
| Apparence | liquide incolore, tres mobile, d'odeur âcre. [1] | ||
| Propriétés chimiques | |||
| Formule brute | C4H6O3 [Isomères] |
||
| Masse molaire | 102, 0886 g∙mol-1 C 47, 06 %, H 5, 92 %, O 47, 02 %, |
||
| Propriétés physiques | |||
| T° fusion | -73 °C[1] | ||
| T° ébullition | 139 °C[1] | ||
| Solubilité | 120 g/L (eau, 20 °C) [2], soluble dans l'éthanol l'acétone, le chloroforme, l'éther diéthylique, l'acétate d'éthyle et le DMSO |
||
| Masse volumique | (eau = 1) : 1.08[1] | ||
| T° d'auto-inflammation | 316 °C[1] | ||
| Point d'éclair | 49 °C c. f. [1] | ||
| Limites d'explosivité dans l'air | en volume % dans l'air : 2.7-10.3[1] | ||
| Pression de vapeur saturante | 5 hPa (20 °C) | ||
| Propriétés optiques | |||
| Indice de réfraction | 1, 386 | ||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Phrases R : 10, 20/22, 34, | |||
| Phrases S : (1/2), 26, 36/37/39, 45, | |||
|
|
|||
|
|||
|
|
|||
|
|
|||
   |
|||
|
|
|||
  Danger |
|||
| Écotoxicologie | |||
| DL50 | 1780mg/kg (rat, oral) [2] | ||
| CL50 | 1000ppm/4H (rat, inhalation) [2] | ||
| Composés apparentés | |||
| Autres composés | acide acétique | ||
|
|
|||
L'anhydride acétique ou anhydride éthanoïque est l'anhydride de l'acide acétique; il est obtenu en liant deux molécules d'acide acétique par condensation avec élimination d'eau (d'où le nom d'anhydride).
L'anhydride acétique dégage des vapeurs irritantes pour les muqueuses oculaires et respiratoires. Ses effets sur le corps humain sont essentiellement des brûlures cutanées dues à un contact avec la peau et des effets lacrymogènes dus aux gaz volatiles. Il faut par conséquent le manipuler avec du matériel de protection et sous une hotte qui aspire les gaz dangereux. Il s'hydrolyse aisément avec l'humidité de l'air et est inflammable.
Rôle dans la synthèse de l'aspirine
L'anhydride acétique est utilisé pour faire la synthèse de l'acide acétylsalicylique, plus connu sous le nom d'aspirine en réagissant avec l'acide salicylique. Cette réaction est lente et incomplète.
Rôle dans la synthèse du paracétamol
L'acylation du p-aminophénol avec de l'anhydride acétique permet d'obtenir du paracétamol.
Références
- ANHYDRIDE ACETIQUE, fiche de sécurité du Programme Mondial sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) «Acetic anhydride» sur ChemIDplus, consulté le 5 juin 2009
- ↑ «Anhydride acétique» dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Recherche sur Google Images : |
|
"brut, l'Afghanistan a" L'image ci-contre est extraite du site probe.20minutes-blogs.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (783 x 867 - 95 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 11/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.




 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité