Monoxyde d'azote
Le monoxyde d'azote, oxyde azotique, oxyde nitrique ou N O est un composé chimique constitué d'un atome d'oxygène et d'un atome d'azote.

Catégories :
Produit chimique comburant - Produit chimique corrosif - Composé de l'azote - Métabolisme de l'azote - Oxyde - Gaz inorganique - Neurotransmetteur - Vasodilatateur
| Monoxyde d'azote | |||
|---|---|---|---|
  |
|||
| Général | |||
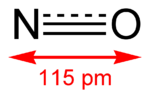
| Nom IUPAC | Monoxyde d'azote | ||
| No CAS | |||
| No EINECS | |||
| Code ATC | R07 | ||
| PubChem | |||
| SMILES |
|
||
| InChI |
|
||
| Apparence | gaz comprime incolore. [1] | ||
| Propriétés chimiques | |||
| Formule brute | NO [Isomères] |
||
| Masse molaire | 30, 0061 g∙mol-1 N 46, 68 %, O 53, 32 %, |
||
| Propriétés physiques | |||
| T° fusion | -163, 6 °C[1] | ||
| T° ébullition | -151, 8 °C[1] | ||
| Solubilité | dans l'eau à 0 °C : 7.4 ml/100 ml[1] | ||
| Masse volumique | 1.3 kg/l (liquide) | ||
| Thermochimie | |||
| S0gaz, 1 bar | 211 J/Mol·K | ||
| ΔfH0gaz | 90 kJ/Mol | ||
| ΔfH0liquide | 87, 7 kJ/Mol | ||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
    |
|||
| Inhalation | Dangereuse, peut conduire à la mort | ||
| Peau | Irritant | ||
| Yeux | Peut causer des irritations | ||
| Ingestion | Utilisé à des fins thérapeutiques, mais présente des effets indésirables et est dangereux en surdosage | ||
|
|
|||
Le monoxyde d'azote, oxyde azotique, oxyde nitrique ou NO est un composé chimique constitué d'un atome d'oxygène et d'un atome d'azote. C'est un gaz dans les conditions normales de pression et de température. C'est un important neurotransmetteur chez les mammifères et l'unique neurotransmetteur gazeux connu.
Le monoxyde d'azote (NO), ne doit pas être confondu avec d'autres oxydes d'azote, tel le monoxyde de diazote N2O, qu'on nomme «gaz hilarant», et qui est un anesthésique général, ou encore tel le dioxyde d'azote NO2, gaz rouge-brun extrêmement irritant et nocif, qui se forme par oxydation rapide de NO par l'oxygène de l'air.
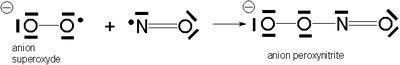
Sa grande réactivité vis-à-vis des composés radicalaires comme l'oxygène moléculaire - qui est un biradical - ou l'anion superoxyde est due au fait qu'il est lui-même un composé radicalaire - son spin électronique total vaut 1/2. En milieu biologique, son temps de demi-vie est estimé entre 1 et 5 secondes[3], ou alors 30 secondes[4]. Les peroxynitrites obtenus sont de puissants agents oxydants et nitrants[5].
Production et effets environnementaux
À haute température, le diazote et le dioxygène réagissent pour donner le monoxyde d'azote, par exemple sous l'effet de la foudre. L'activité humaine a radicalement modifié la production de monoxyde d'azote, qui se forme dans les chambres de combustion des moteurs à explosion. Un des buts des pots d'échappement catalytiques est d'inverser cette réaction.
Propriétés[6]
Les propriétés chimiques du monoxyde d'azote sont particulièrement nombreuses. Ce qui suit est une bref survol de ses méthodes de préparation et de sa réactivité.
Préparation
Le monoxyde d'azote est constitué à partir des éléments à haute température, ainsi qu'il l'a été indiqué plus haut.
Il peut être synthétisé au laboratoire selon les réactions d'oxydoréduction suivantes, où un dérivé azoté de degré d'oxydation supérieur à +II (acide nitrique : +V ; acide nitreux : + III) est traité par le réducteur correct. Toutes ces réactions doivent être mise en œuvre en l'absence d'oxygène, car ce dernier oxyde rapidement NO en dioxyde d'azote. :
Ainsi la réduction de l'acide nitrique par le cuivre
8HNO3 + 3Cu → 3Cu (NO3) 2 + 4H2O + 2NO
ou celle de l'acide nitreux (formé in situ) par les ions iodure ou ferreux
2NaNO2 + 2NaI + 2H2SO4 → I2 + 4NaHSO4 + 2NO
2NaNO2 + 2FeSO4 + 3H2SO4 → Fe2 (SO4) 3 + 2NaHSO4 + 2H2O + 2NO
La réaction précédente est une méthode simple permettant d'obtenir NO au laboratoire.
Le monoxyde d'azote peut aussi être obtenu en milieu anhydre grâce à la réduction de nitrates et de nitrites par le chrome III :
3KNO2 (l) + KNO3 (l) + Cr2O3 (s) → 2K2CrO4 (s) + 4NO
La synthèse industrielle de NO consiste en l'oxydation de l'ammoniac par l'oxygène de l'air en présence de mousse de platine vers 750 à 900 °C.
Réactivité
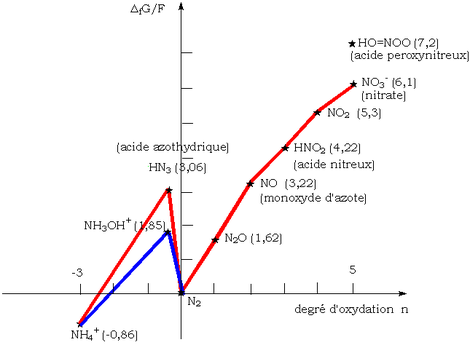
Le diagramme de Frost à pH =0 de l'azote montre quoique le monoxyde d'azote est instable et qu'il devrait se dismuter en diazote et en acide nitrique. Il est en fait particulièrement aisément oxydé en dioxyde d'azote, plus stable, par l'oxygène de l'air. C'est pourquoi on observe les vapeurs rousses de ce dernier gaz quand on oxyde le cuivre par l'acide nitrique concentré.
Une hypothèse plausible est que le biradical O2 se lie à deux radicaux NO pour donner ON-OO-NO, qui subit ensuite une rupture homolytique conduisant à NO2.
Cependant, en l'absence d'oxygène, il se dismute vers 50 °C en N2O (monoxyde de diazote ou gaz hilarant et NO2 (vapeurs rousses). À 25 °C, la vitesse de la réaction est quasiment nulle, et NO y est métastable.
En solution aqueuse, NO se dissout pour donner de l'acide nitreux HNO2, selon le schéma réactionnel envisageable suivant :
4NO + O2 + 2H2O → 4HNO2
NO réagit avec le difluor, le dichlore et le dibrome pour donner des composés du type X-NO, connus sous le nom d'halogénures de nitrosyle. L'iode est trop peu oxydant pour donner lieu à la formation d'iodure de nitrosyle.
L'iodotrifluorométhane réagit avec NO pour donner un des rares gaz bleus connus, le nitrosotrifluorométhane :
NO + CF3I → I2 + CF3NO
La vitesse de formation de l'ion peroxynitrite à partir du monoxyde d'azote et de l'ion superoxyde est de 1, 9.1010 mol-1s-1, ce qui implique la présence de peroxynitrite in vitro et in vivo au moindre excès de ses deux précurseurs [7].
Le monoxyde d'azote est aussi un ligand [8]
La molécule de monoxyde d'azote est apparentée à celle du monoxyde de carbone CO, avec la différence qu'il comporte un électron supplémentaire, qui occupe une orbitale p antiliante. C'est ainsi que NO forme des complexes du même type que ceux constitués avec CO, l'angle de la liaison M-N=O étant quasiment égal à 180° - en réalité cet angle fluctue entre 160° et 180°.
Ces complexes sont par conséquent reconnus comme linéaires. Dans ce cas, l'azote engage formellement son doublet libre dans la liaison de coordination. Cependant, l'azote est oxydé car il donne son électron célibataire au métal qu'il coordine et qui est par conséquent réduit. Ainsi les complexes tétracarbonylonickel, nitrosylotricarbonylocobalt et dicarbonylodinitrosylofer sont-ils isostructuraux (tétraédriques) car isoélectroniques.
NO peut former des complexes en ne donnant qu'un seul électron au métal. Cela conduit à un groupe M-N-O où l'angle de liaison est compris entre 120° et 140°.
Il peut aussi jouer le rôle de pont entre deux centres métalliques par le biais de l'azote.
Réactions des complexes nitrosyle
La chimie des composés de coordination de NO est vaste et ne sera abordée que brièvement. Par exemple NO s'insère entre le niobium et un ligand méthyle dans la réaction suivante :
Caractérisation du NO coordiné
Les NO terminaux peuvent être reconnus par leur absorption infrarouge intense à 1610 cm-1. Les nombres d'onde d'absorption IR des dérivés angulaires sont inférieurs.
Analyse quantitative
L'analyse quantitative du monoxyde d'azote met en œuvre une simple réaction chemiluminescente avec l'ozone [9].
Un échantillon contenant NO est mélangé avec une quantité d'ozone en excès. Le monoxyde d'azote réagit en formant de l'oxygène et du dioxyde d'azote. La réaction libère aussi de l'énergie sous forme d'ondes électromagnétiques dans le visible : c'est la chemiluminescence. L'intensité de la lumière produite, mesurée grâce à un photodétecteur, est proportionnelle à la quantité de monoxyde d'azote. Un exemple d'application thérapeutique du NO est sa mesure dans l'air expiré des patients (asthmatiques pour la majorité). Le principe consiste à souffler dans un appareil de chemiluninescence et ainsi mesurer le NO exhalé et par conséquent mesurer l'inflammation des voies respiratoires.
On peut aussi doser par diverses méthodes électrochimiques (potentiométrie avec le permanganate de potassium [10], polarographie)
Applications techniques
Fonctions biologiques[11]
NO est une molécule endogène libérée par les cellules endothéliales, les macrophages, les cellules du foie et les neurones.
Dans l'organisme le monoxyde d'azote remplit plusieurs fonctions.
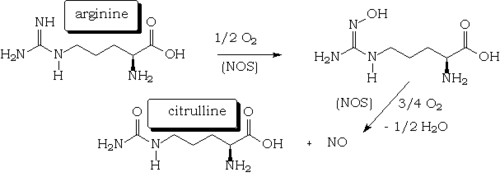
Il est synthétisé naturellement par le corps à partir de la L-arginine et de l'oxygène par plusieurs enzymes dites NO synthases (NOS), qui sont des hémoprotéines[12] proches du cytochrome P450. Le catalyseur de l'oxydation par l'oxygène du groupement iminourée de l'arginine est par conséquent le fer de l'hème qui passe du degré d'oxydation + II au degré + III et vice-versa.
La liaison du NO aux thiols de bas poids moléculaire - tels que le glutathion - conduit à la formation de S-nitrosothiols qui formeraient un déterminant important pour l'activité et le transport du NO. Ces composés peuvent subséquemment agir comme donneurs de NO et ainsi augmenter substantiellement sa demi-vie [13].
L'activité cellulaire du monoxyde d'azote passe par deux voies principales, celle qui consiste en la production de Guanosine monophosphate cyclique intra-cellulaire (GMPc) à partir de la Guanosine triphosphate (GTP), et la formation de peroxynitrites cytotoxiques [14]. L'augmentation de la concentration de GMP cyclique passe par l'activation d'une guanylate cyclase cytoplasmique (non membranaire).
Vasodilatateur
L'endothélium des vaisseaux sanguins se sert du NO pour déclencher le relâchement de sa tunique de muscle lisse, provoquant ainsi une vasodilatation et un accroissement du débit sanguin et une diminution de l'agrégation des plaquettes sanguines (thrombocytes) . On pense que ce mécanisme est indispensable à la préservation de l'endothélium. Chez une grande proportion d'humains, cette synthèse de NO se révèle insuffisante, augmentant par là même leur risque de présenter une maladie cardio-vasculaire. Ce mécanisme explique l'utilisation des dérivés nitrés comme la trinitrine dans le traitement de ces mêmes maladies cardiaques : Ces médicaments sont transformés en NO, d'une manière non toujours complètement élucidée, qui à son tour dilate les artères coronaires, vaisseaux sanguins irriguant le cœur, augmentant son apport sanguin.
L'EDRF (endothelium-derived relaxing factor) est le nom ancien du NO. D'anciens médecins avaient remarqué son rôle vasodilatateur mais ne l'avaient pas encore identifié chimiquement.
Microbicide
Les macrophages, cellules du dispositif immunitaire, produisent du NO dans l'objectif d'éliminer des bactéries pathogènes, NO qui peut, dans certaines circonstances, provoquer des effets secondaires nuisibles : c'est le cas dans les infections fulminantes dites septicémies, où la production excessive de NO par les macrophages conduit à une vaso-dilatation massive, cause principale de l'hypotension artérielle rencontrée dans le choc septique.
Neurotransmetteur
Le NO joue le rôle d'un neurotransmetteur entre cellules nerveuses. À la différence de la majorité des autres neurotransmetteurs, dont l'action dans la fente synaptique a pour cible unique le neurone post-synaptique, la petite molécule de NO diffuse beaucoup et peut atteindre plusieurs neurones environnants, y compris des neurones non inter connectés par des synapses. On pense que ce processus est impliqué dans la mémorisation en assurant la mémorisation à long terme. Les endocannabinoïdes, neurotransmetteurs lipidiques, ont des propriétés de diffusion identiques.
Relaxant des muscles lisses
Le NO est présent dans plusieurs organes du tube digestif comme neuro-transmetteur non-adrénergique, non-cholinergique. Il est responsable de la relaxation des muscles lisses de l'appareil gastro-intestinal. Surtout il accroît la capacité de l'estomac à stocker des liquides alimentaires.
Régulateur de l'apoptose
Le monoxyde d'azote est un régulateur essentiel de l'apoptose cellulaire. Il peut avoir un effet antiapoptotique, ou, inversement, un effet apoptotique[15]. Cette bascule est intimement liée à la présence ou non de réducteurs cellulaires tels de glutathion.
En présence d'un taux élevé d'ion superoxyde O2-, le monoxyde d'azote permet la formation d'ion peroxynitrite[16], certainement responsable de la modification du potentiel de membrane mitochondrial mais aussi de nombreux phénomènes d'apoptose cellulaire, surtout celle des cellules du dispositif immunitaire[17], [18].
Donneurs exogènes de NO
Ce sont des substances comportant une ou plusieurs liaisons azote - oxygène, azote - azote ou inhibant la destruction de NO (viagra). On y retrouve les nitrates, nitrites, dérivés nitrés, azotures, ... [19], [20]
Utilisations thérapeutiques
Utilisations thérapeutiques[21] :
- Il est utilisé en médecine comme vasodilatateur inhalé. L'utilisation de vasodilatateurs inhalés sert à vasodilater de façon sélective les capillaires des zones pulmonaires bien ventilées. Ceci sert à diminuer l'Hypertension artérielle pulmonaire liée à la vasoconstriction hypoxique et d'augmenter l'oxygénation du sang.
- Un composé appelé Diméthyl-Arginine Asymétrique (ADMA) est un inhibiteur connu de la synthèse de NO, et est par conséquent reconnu comme un marqueur biologique de dysfonction cardio-vasculaire.
- La production de NO joue aussi un rôle important dans l'obtention et la conservation d'une érection durable. Des concentrations accrues de GMPc amènent à une vaso-dilatation et une érection de meilleure qualité. On pense que l'effet des «poppers» est obtenu aussi par l'intermédiaire du NO, provoquant une relaxation des fibres musculaires lisses qui entourent les artérioles irriguant les corps caverneux du pénis et augmentent l'afflux sanguin. Le sildénafil (Viagra) et le tadalafil (Cialis), sont des inhibiteurs compétitifs de l'enzyme Phosphodiestérase type 5 (PDE5) responsable de l'inactivation du GMP cyclique en GMP.
La découverte des propriétés biologiques du NO dans les années 1980 fût totalement inattendue et provoqua une certaine agitation. Le journal Science appela le NO «Molécule de l'année» en 1992, une Société savante du NO fut créée et une revue scientifique entièrement consacrée au NO parut. Le Prix Nobel de Médecine et de Physiologie[22] fut remis en 1998 à Ferid Murad, Robert F. Furchgott, et Louis J. Ignarro pour leurs travaux sur les fonctions de neurotransmission du NO. Ces travaux sont à l'origine de la fondation de la société pharmaceutique française Nicox. On estime à 3000 par an la parution d'articles scientifiques sur le rôle en Biologie du monoxyde d'azote.
Sécurité
Référence ONU pour le transport de matières dangereuses :
- Nom (français) : Monoxyde d'azote comprimé
- Classe : 2
- numéro : 1660
Notes et références
- MONOXYDE D'AZOTE, fiche de sécurité du Programme Mondial sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ «Monoxyde d'azote» dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Gabbai, F. B., Garcia, G. E. et al. , «Role of nitric oxide in glomerular physiology and pathophysiology», Adv Nephrol Necker Hosp 24, 3-18 (1995)
- ↑ R. A. Schrœder et P. C. Kuo, Nitric oxide : physiology and pharmacology», Anesth Analg 81, 1052-9 (1995)
- ↑ Enthalpie d'isomérisation de l'ion peroxynitrite en nitrate
- ↑ R. B. King; Inorganic Chemistry of Main Group Elements, VCH Publishers, New York, 1995.
- ↑
- ↑ F. A. Cotton, G. Wilkinson, C. A. Murillo, M. Bochmann; Advanced Inorganic Chemistry, 6th ed. Wiley-Interscience, New York, 1999.
- ↑ Fischer G & Becknell D ; Anal. Chem., 44, 863, 1972
- ↑ Kieselbach, Ind. Eng. Chem., Anal. Ed., 16, 766, 1944
- ↑ Pharmacorama ; Monoxyde d'azote
- ↑ Nitric oxide synthase is a cytochrome P-450 type h... [Biochemistry. 1992] - PubMed Result
- ↑ Andrews, K. L., Triggle, C. R. et al. NO and the vasculature : where dœs it come from and what dœs it do? Heart Fail Rev 7, 423-45 (2002)
- ↑ Métabolisme du monoxyde d'azote
- ↑ Nitric oxide as bifunctional regulator of apoptosis
- ↑
- ↑ Contrasting effects of NO and peroxynitrites on HSP70 expression and apoptosis in human monocytes; Adrie C & al. Am J Physiol Cell Physiol 279 :452-460, 2000.
- ↑ Functional studies of an HIV-1 encoded glutathione peroxidase
- ↑ NO and NO-donors
- ↑ Sodium azide as indirect nitric oxide donor : researches on the rat aorta isolated segments ; Ukr Biokhim Zh. 2005 Jul-Aug;77 (4) :120-3
- ↑ Utilisation clinique de l'oxyde nitrique ; Olson G.
- ↑ 1998 Prix Nobel de Médecine pour la découverte du rôle de NO dans la régulation cardiovasculaire
Voir aussi
- Syndrome de détresse respiratoire aiguë
- Neurotransmetteur
- EDRF : Endothelium-derived relaxing factor non donné à cette même molécule avant qu'on connaisse sa formule chimique
- Transduction de signaux
Liens externes
- Nitric Oxide : Biology and Chemistry, journal scientifique.
- Club NO, Société Française du Monoxyde d'Azote.
Recherche sur Google Images : |
|
"capteur de monoxyde d'azote" L'image ci-contre est extraite du site directindustry.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (1000 x 569 - 42 ko - )Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 11/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.
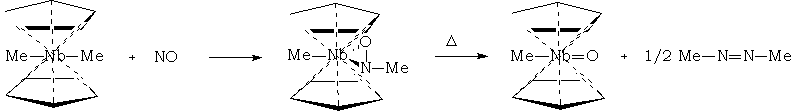

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité